Matteo Cameli, MD, PhD, Giulia Elena Mandoli, MD
UOC Cardiologia, AOUS, Dipartimento di Biotecnologie Mediche, Università di Siena
Lo scompenso cardiaco raggiunge la sua fase terminale in oltre il 10% dei pazienti. Il trapianto cardiaco rappresenta ancora oggi il gold standard del suo trattamento ma è gravato da una rilevante sproporzione tra il numero di pazienti richiedenti e i donatori. Per ovviare al problema, sono state ricercate negli anni strategie alternative tra cui l’utilizzo di un dispositivo di assistenza ventricolare sinistra come soluzione a lungo termine.
Parole chiave: scompenso cardiaco avanzato; trapianto cardiaco; donatori marginali; LVAD; scompenso cardiaco destro.
________________________________________________________________________________
Una quota sempre maggiore, stimata fino al 10%, di pazienti affetti da insufficienza cardiaca raggiunge quello stadio di malattia definito come “avanzato” o “terminale”, nonostante cure mirate ed ottimali verso le quali il soggetto diviene refrattario. Questi pazienti presentano sintomi di scompenso cardiaco severi e persistenti, una importante riduzione della capacità di svolgere anche le più semplici attività quotidiane e richiedono visite cardiologiche più frequenti oppure ripetuti ricoveri ospedalieri a causa della congestione polmonare. Esistono dei veri e propri centri cardiologici specializzati nella gestione dei pazienti con insufficienza cardiaca avanzata. Come descritto anche nelle più recenti Linee Guida per la gestione e la cura dei pazienti con scompenso cardiaco, pubblicate dalla Società Europea di Cardiologia nel 2021, la terapia di riferimento (gold standard) a lungo termine per questa quota di pazienti è rappresentato ancora oggi dal trapianto cardiaco che ha dimostrato di garantire un aumento della sopravvivenza e un miglioramento della qualità di vita. Il trapianto di cuore ha delle precise indicazioni ma soprattutto molte controindicazioni, rappresentate ad esempio dalla presenza di patologie oncologiche in atto o recenti, infezioni attive, malattia renale irreversibile, obesità severa etc. Se il paziente riesce a diventare un ottimo candidato per il trapianto dovrà poi trovarsi di fronte alla principale problematica che limita ad oggi il suo utilizzo: la grande sproporzione tra il numero di richiedenti e il numero di donatori. Per far fronte a questa problematica, si sono cercate negli ultimi anni strategie per ampliare il pool di cuori da destinare al trapianto. Il protocollo ADONHERS (Aged DONor HEart Rescue by Stress echo) è stato sviluppato dapprima in Toscana ed Emilia-Romagna e quindi su territorio nazionale per il reclutamento di donatori marginali ovvero soggetti in morte cerebrale di età maggiore di 55 anni o minore ma in presenza di più fattori di rischio cardiovascolari (come l’ipertensione arteriosa, il diabete mellito, la dislipidemia) che vengono sottoposti ad ecocardiografia da stress farmacologico con dipiridamolo. I cuori che durante il test non sviluppano anomalie della funzione globale o segmentaria del ventricolo sinistro e dimostrano riserva contrattile conservata, vengono espiantati con dimostrati buoni risultati in termini di sopravvivenza ed eventi avversi, sovrapponibili e quelli di donatori standard. Inoltre, la possibilità di cura dell’infezione da virus dell’epatite C (HCV) recentemente disponibile, ha permesso di utilizzare anche cuori da donatori HCV positivi. L’utilizzo di dispositivi di assistenza meccanica a lungo termine rappresenta un’altra strategia sempre più applicabile per ridurre la carenza di donatori. I dispositivi di assistenza al ventricolo sinistro, chiamati LVAD (left ventricular assist devices) possono essere impiantati sia in pazienti già in lista per trapianto cardiaco come ponte per migliorare la capacità funzionale e la qualità di vita, sia, in maniera sempre crescente, come scelta terapeutica definitiva in soggetti che per età o controindicazioni non possono intraprendere il percorso trapianto. LVAD è un dispositivo a pompa centrifuga dotato di minima pulsatilità intrinseca che viene posizionato a livello dell’apice del ventricolo sinistro e sostituisce la funzione di questa camera cardiaca immettendo sangue in aorta per garantire una sufficiente portata in tutto l’organismo. In figura 1 sono mostrati i componenti che costituiscono il dispositivo. Rispetto ai precedenti dispositivi, la sopravvivenza a 5 anni è stata descritta fino al 100% con tassi nettamente inferiori di ictus o malfunzionamento rispetto ai modelli precedenti. Sia la capacità funzionale soggettiva (descritta tramite la classe New York Heart Association) che quella oggettiva (testata mediante test del cammino dei sei minuti) subiscono un significativo miglioramento dopo l’impianto. Una condizione essenziale per garantire ottime performance del dispositivo a lungo termine è rappresentato dall’accurata selezione dei pazienti prima dell’impianto. Solitamente i pazienti con scompenso cardiaco avanzato che potrebbero beneficiare di un LVAD vengono inviati ad un centro di riferimento dove vengono sottoposti ad uno screening completo. Quest’ultimo comprende tra l’altro:
l’esclusione di infezioni attive che potrebbero compromettere il funzionamento della macchina;
l’esclusione di predisposizione ad emorragie del tratto gastrointestinale, genitourinario, cerebrale o di altre sedi. Il dispositivo infatti richiede una terapia anticoagulante a lungo termine basata sostanzialmente su eparina o inibitori della vitamina K mentre i nuovi anticoagulanti orali non sono stati validati in questa popolazione di pazienti e pertanto risultano controindicati;
una valutazione ecocardiografica completa mirata principalmente alla valutazione delle valvola aortica e della funzione del ventricolo destro.
La presenza di una insufficienza aortica di rilievo emodinamico rappresenta, a meno che non venga chirurgicamente corretta, una controindicazione al posizionamento del LVAD in quanto il reflusso di sangue dalla radice aortica al ventricolo ne ridurrebbe quasi completamente l’efficienza. Lo scompenso del ventricolo destro complica il 20-50% degli impianti, impattando sulla sopravvivenza già nell’immediato post-operatorio. Dopo l’impianto di un LVAD, la portata del ventricolo destro deve essere in grado di aumentare per supportare il lavoro del dispositivo, pertanto, una accurata valutazione volta ad escludere una disfunzione destra presente è una condizione necessaria per confermare la candidabilità all’intervento. È necessaria in particolare l’esecuzione di una ecocardiografia completa comprensiva di parametri standard ed avanzati.
Il Centro Coordinatore Regionale per il Trapianto di Cuore è attivo a Siena sotto la responsabilità della Professoressa Serafina Valente, direttore del Dipartimento Cardio-Toraco-Vascolare e come da delibera della Regione Toscana n. 473/2021 risulta essere il Centro regionale assegnatario della programmazione degli impianti LVAD.
Dall’esperienza maturata negli anni di impianti del Centro, già dal 2017 è stato validato il SIENA SCORE (Figura 2), comprensivo di 4 indici di funzione e struttura ventricolare destra: tricuspid annular plane excursion (TAPSE), right ventricular fractional area change (RVFAC), l’indice di sfericizzazione e il grado di deformazione sull’asse longitudinale della parete libera del ventricolo destro mediante metodica Speckle Tracking. Questo punteggio è in grado di stratificare il rischio di scompenso cardiaco destro post-impianto di LVAD.
In futuro trattamenti dello scompenso cardiaco avanzato basate su terapia genetica volta a modificare proteine o RNA cellulare potrebbero rappresentare opzioni sia nell’attesa di trapianto cardiaco sia nei cuori già impiantati ad esempio per ridurre il rischio di rigetto o di coronaropatia.
FIGURE
Figura 1. Dispositivo di assistenza ventricolare sinistra (LVAD).
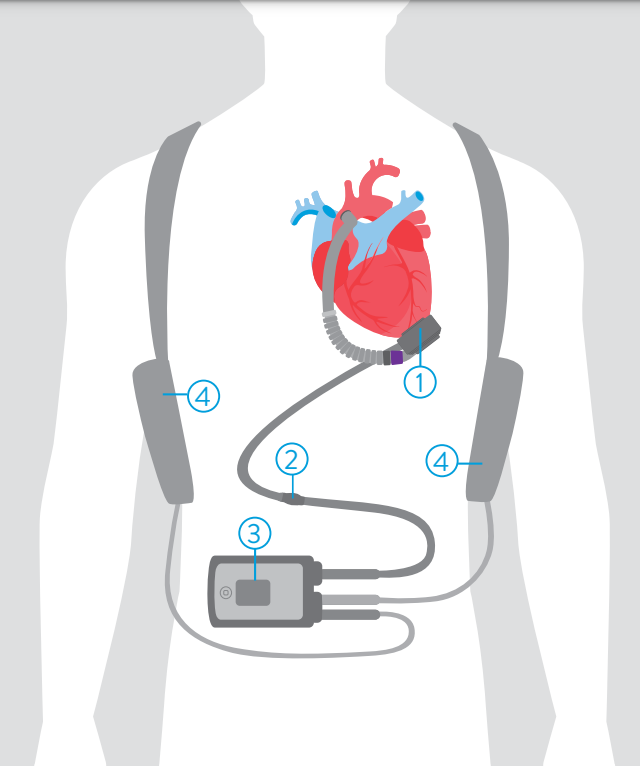
1. Pompa cardiaca (posizionato all’apice del ventricolo sinistro); 2. Driveline (trasferisce corrente ed informazioni tra controller e pompa cardiaca); 3. Controller (fornisce energia e controlla il corretto funzionamento della pompa cardiaca e della driveline); 4. Batterie.
Figura 2. Protocollo SIENA, punteggio ecocardiografico per la valutazione del rischio di scompenso cardiaco destro dopo impianto di dispositivo di assistenza ventricolare sinistra.
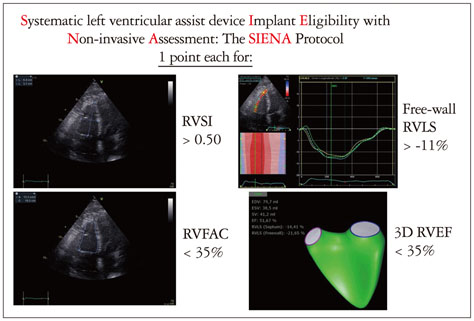
RVEF = right ventricular ejection fraction; RVFAC = right ventricular fractional area change; RVLS = right ventricular longitudinal strain; RVSI = right ventricular sphericity index
Cameli M, Loiacono F, Sparla S, Solari M, Iardino E, Mandoli GE, Bernazzali S, Maccherini M, Mondillo S. Systematic Left Ventricular Assist Device Implant Eligibility with Non-Invasive Assessment: The SIENA Protocol. J Cardiovasc Ultrasound. 2017 Jun;25(2):39-46. doi: 10.4250/jcu.2017.25.2.39. Epub 2017 Jun 29. PMID: 28770031; PMCID: PMC5526884.
matteo.cameli@yahoo.com

