SOSD fisiopatologia e Riabilitazione Respiratoria, Osp. P. Palagi (Firenze), ASL Toscana Centro
Eziologia e clinica
Insufficienza cardio-circolatoria, insufficienza renale, insufficienza epatica, del pancreas, del midollo osseo, insufficienza respiratoria; insufficienza della funzioni e degli organi più vari, fino all’insufficienza multiorgano. Tutte queste situazioni sono accumunate dalla stessa definizione: si tratta di un organo (o almeno di due, nel caso della multiorgano), un sistema o un apparato che non riesce a far fronte alle necessità dell’organismo.
Se ci riferiamo particolarmente all’insufficienza respiratoria, questa può essere intesa come l’incapacità / impossibilità dell’apparato di mantenere a livelli adeguati gli scambi gassosi fra aria ambiente e gli organi; non è più in grado cioè di provvedere all’ossigenazione e / o ad eliminare l’anidride carbonica dal sangue venoso misto. Si definisce pertanto insufficienza respiratoria la condizione in cui nel sangue arterioso non vengono raggiunti livelli normali di pressione parziale di ossigeno (PaO2) e di anidride carbonica (PaCO2) (1). Per quanto riguarda la PaO2, esistono limiti di normalità relativamente ampi in quanto questo valore si modifica con l’età: aumenta dall’infanzia sino all’età adulta per poi diminuire progressivamente con l’invecchiamento. Per definire l’ipossiemia occorrerebbe dunque fare riferimento a valori che si discostano per difetto da quelli teorici per la fascia di età in discussione; tuttavia, convenzionalmente, si definiscono diagnostici di insufficienza respiratoria valori inferiori a 60 mmHg. Il valore di PaO2 appena indicato costituisce un limite critico in quanto a questo livello inizia la porzione di discesa più ripida della curva di dissociazione per l’emoglobina, cioè quella nella quale riduzioni anche modeste della PaO2 stessa si traducono in cadute marcate della saturazione ossiemoglobinica (Fig. 1).
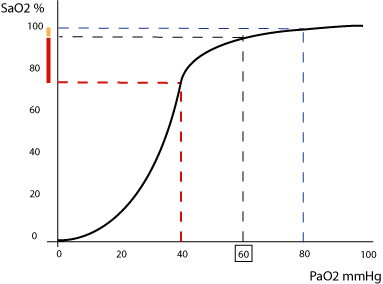
Per quanto riguarda la PaCO2, i limiti di variabilità interindividuale sono più stretti: infatti la condizione di ipercapnia è definita da un livello di PaCO2 più elevato rispetto ai limiti superiori della norma, pari a 45 mmHg. (1) Un livello efficiente di scambi gassosi polmonari non è sempre sufficiente ad assicurare un adeguato apporto di ossigeno ai tessuti: perché ciò avvenga è infatti necessario che anche il trasporto e l’utilizzazione periferica dell’ossigeno siano nella norma. Per convenzione però le condizioni di deficit dell’apporto di ossigeno da queste cause non vengono classificate come insufficienza respiratoria. Queste forme di ipossia possono essere distinte in:
- ipossia da stasi (da ridotta portata cardiaca o ridotta perfusione tissutale)
- anemica (da riduzione del patrimonio emoglobinico)
- istotossica (da alterazione dei meccanismi di utilizzazione periferica dell’ossigeno, come avviene per esempio nell’avvelenamento da cianuri)
L’insufficienza respiratoria si può classificare in:
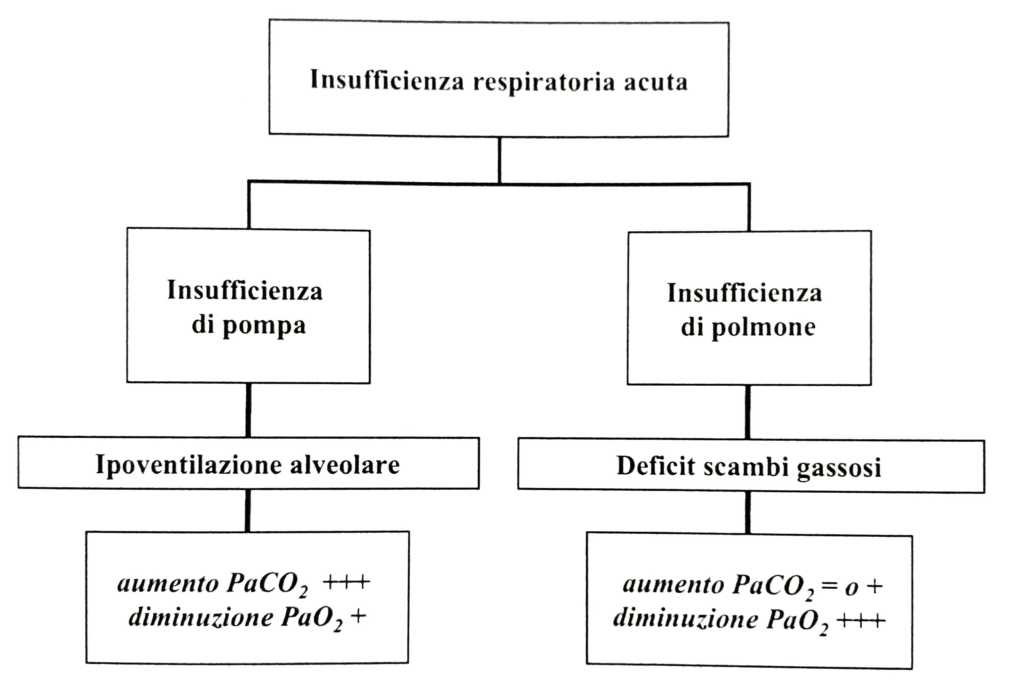
– Tipo I o parziale: è la condizione nella quale il deficit degli scambi gassosi interessa soltanto l’assunzione dell’ossigeno, e che pertanto si manifesta con un’ipossiemia senza ipercapnia; essa consegue ad una compromissione della funzione del parenchima polmonare o da danno polmonare acuto [acute lung injury (ALI); edema polmonare ipoteso], la cui espressione più grave è la sindrome da distress respiratorio acuto (ARDS). Questa si può verificare in molteplici situazioni: sepsi, aspirazione di contenuto gastrico, semi-annegamento, ripetute emotrasfusioni, pancreatite, polmoniti ecc, in particolare quelle di più recente memoria: SARS (identificata una dozzina di anni fa da Carlo Urbani) e la ancora attualissima SARS-CoV-2. Può essere sintetizzata con l’espressione “lung failure” (Fig. 2).
– Tipo II o globale: caratterizzata sia da un deficit dell’ossigenazione sia da un’insufficiente rimozione della CO2 con conseguente ritenzione della stessa, si manifesta con ipossiemia associata a ipercapnia. Consegue ad una compromissione della funzione della pompa ventilatoria, o “pump failure” (Fig. 2). Ancora, questo tipo di insufficienza respiratoria può svilupparsi a seguito di un sovraccarico del sistema respiratorio, per aumento delle resistenze (broncospasmo), ridotta compliance sia del polmone (edema alveolare, atelettasia, auto-PEEP) che della parete toracica (pneumotorace, versamento pleurico, sovradistensione addominale). Anche un aumento delle richieste ventilatorie (sepsi, embolia polmonare) può portare ad insufficienza respiratoria ipercapnica.
Si riporta per completezza che sono stati descritti anche altri due tipi di insufficienza respiratoria:
– Tipo III: è il risultato di atelettasia polmonare. Dato che questa è una condizione relativamente frequente nel periodo postoperatorio, è chiamata anche “insufficienza respiratoria perioperatoria”. Si può verificare dopo anestesia generale, a seguito della riduzione della capacità funzionale residua per collasso di zone polmonari. Viene trattata con frequenti cambi di posizione, precoce assunzione dell’ortostatismo, fisioterapia; se necessario, anche con ventilazione non invasiva a pressione positiva.
– Tipo IV: è dovuta alla ipoperfusione dei muscoli respiratori in pazienti in shock. In condizioni normali, i muscoli respiratori richiedono meno del 5% della portata cardiaca e dell’apporto totale di ossigeno. I pazienti in shock però spesso si trovano in condizioni di distress respiratorio: per edema polmonare (shock cardiogeno), acidosi lattica (ipoperfusione periferica), anemia (shock emorragico, infusione di fluidi). In questa situazione, la richiesta dai muscoli respiratori può salire fino al 40% della portata cardiaca, e il ricorso all’intubazione e alla ventilazione meccanica è in grado di ridurre questa richiesta, permettendo quindi di redistribuire il flusso ematico agli organi vitali.
L’eziologia dell’insufficienza respiratoria in base alla usuale classificazione in Tipo I e TipoII è illustrata nella Tab 1.
In rapporto alle modalità di insorgenza l’insufficienza respiratoria può essere acuta o cronica. Entrambe possono manifestarsi sottoforma di insufficienza respiratoria di tipo I o II.
Infine si parla di insufficienza respiratoria manifesta quando può essere rilevata anche a riposo e latente se evidente durante esercizio fisico.
Tabella 1. Insufficienza respiratoria: Eziologia
| Insufficienza respiratoria Tipo I (lung failure) | Insufficienza respiratoria Tipo II (pump failure) |
| Polmoniti | Centri respiratori del tronco encefalico (es.: sedativi / ipnotici, eccesso di O2) |
| Edema polmonare acuto cardiogeno (EPA) | Motoneuroni centrali (es.: trauma del midollo cervicale) |
| Acute respiratory distress syndrome (ARDS) | Cellula delle corna anteriori (es.: poliomielite) |
| Trombo-embolia polmonare (TEP) | Motoneuroni periferici (es.: poliradicolopatia ascendente, Sclerosi Laterale Amiotrofica) |
| Vasculiti | Giunzione (placca) neuromuscolare (es.: miastenia grave) |
| Annegamento | Muscoli respiratori (es.: miopatie, distrofie muscolari, fatica muscolare) |
| Enfisema polmonare | Gabbia toracica (es.: cifoscoliosi, fibrotorace, toracoplastica, spondilite anchilosante, volet costali) |
| Aspirazione | Vie aeree intra-parenchimali (broncopneumopatia cronica ostruttiva, BPCO) |
| Asma grave | |
L’insufficienza respiratoria acuta si instaura rapidamente ed in genere ha conseguenze gravi per il ritardo con cui entrano in funzione i meccanismi di compenso: nella forma globale si accompagna ad acidosi scompensata. Tra le cause: intossicazione da barbiturici, encefaliti, traumi, ARDS, edema polmonare acuto, embolia polmonare massiva, polmoniti e pneumotorace iperteso. L’insufficienza respiratoria cronica si caratterizza per l’insorgenza più lenta. Nella forma globale è associata ad un aumento dei bicarbonati e ad un pH vicino alla norma, essendo i meccanismi renali già impegnati; essa può però riacutizzarsi superando le possibilità di compenso renale. Tra le cause si annoverano disordini del controllo ventilatorio (da farmaci o da ipoventilazione primaria), malattie della parete toracica (malattie dei muscoli, cifoscoliosi) malattie polmonari [bronco-pneumopatia cronica ostruttiva (BPCO), interstiziopatie, pneumoconiosi, microembolie polmonari ricorrenti].
La patogenesi dell’insufficienza respiratoria riconosce quattro possibili meccanismi:
1) alterazione del rapporto ventilazione / perfusione per irregolare distribuzione topografica, nelle patologie polmonari diffuse: la ventilazione al minuto tende ad aumentare sino al punto di normalizzare la PaCO2 ma non è altrettanto efficace per la PaO2. Questo meccanismo, il più frequente in assoluto, caratterizza in misura diversa tutte le forme di patologie polmonari diffuse;
2) shunt veno-arterioso: caratteristica è la mancata risposta all’inalazione di ossigeno; si realizza per esempio in caso di polmoniti, edema polmonare, atelectasia;
3) alterazioni della diffusione alveolo-capillare dell’ossigeno per perdita di integrità della membrana alveolo-capillare: costituiscono un meccanismo possibile nelle interstiziopatie diffuse; la PaCO2 per le caratteristiche di maggiore diffusibilità dell’anidride carbonica non si modifica per effetto dell’alterazione di membrana;
4) ipoventilazione alveolare, spesso associata ad ipercapnia, riconosce cause che possono essere distinte in polmonari (per esempio la BPCO) ma più tipicamente sono extrapolmonari: malattie del sistema nervoso centrale (es.: poliomielite bulbare), della trasmissione sinaptica a livello della placca neuromuscolare (miastenia) o dei muscoli (distrofie e atrofie muscolari). Da ricordare anche le anomalie della gabbia toracica (es.: cifoscoliosi).
Epidemiologia
Dal punto di vista epidemiologico, non è facile dare una dimensione esatta del problema. E’ esperienza comune vedere che nei nostri Pronto Soccorso, nei nostri Reparti di degenza ordinaria e di terapia intensiva, nei nostri Ambulatori molte persone giungono con emogasanalisi o anche semplicemente una saturimetria non invasiva indicante un qualche grado di insufficienza respiratoria, ma quando andiamo a cercare dati numerici dobbiamo di solito accontentarci di report piuttosto limitati e settoriali, spesso anche molto datati. Dalla fine del 2019 è poi intervenuta la pandemia SARS-CoV-2 a cambiare radicalmente e, si spera, temporaneamente l’epidemiologia dell’insufficienza respiratoria. Ci concentreremo quindi sul periodo pre-pandemia.
Un commento del 2003 (6) riporta, per l’insufficienza respiratoria acuta, una incidenza compresa tra 77,6 e 88,6 per 100.000 persone all’anno; riporta inoltre fra 17,9 e 34,0 casi per ALI e da 12,6 a 28,0 casi per ARDS, sempre su 100.000 persone / anno; viene inoltre indicata una mortalità di circa il 40% per l’insufficienza respiratoria acuta, di poco inferiore per ALI e ARDS. Precisa che resta incerto se esista una variabilità stagionale fra le varie forme di insufficienza respiratoria.
Una survey del 2020 (7) relativa agli anni 2002-2017 (e quindi sempre riferita all’era pre-COVID) riporta che nel solo 2017 negli Stati Uniti vi sono state 3.213.030 dimissioni ospedaliere con la diagnosi International Classifications of Diseases, 9a revisione (ICD-9) di “insufficienza respiratoria”, 903.745 dimissioni con un codice di procedura “ventilazione meccanica invasiva” e 1.146.195 per la diagnosi insufficienza respiratoria associata ad un codice procedurale di ventilazione meccanica, sia invasiva che non invasiva. Combinando questi codici, come illustrato nelle Figure 3 e 4, risulta che nel corso degli anni considerati si è verificato un aumento di incidenza in tutte le situazioni considerate ma la mortalità ospedaliera è andata diminuendo. Da notare il grande incremento nel tempo del ricorso alla ventilazione non invasiva, mentre l’invasiva non è cambiata di molto.
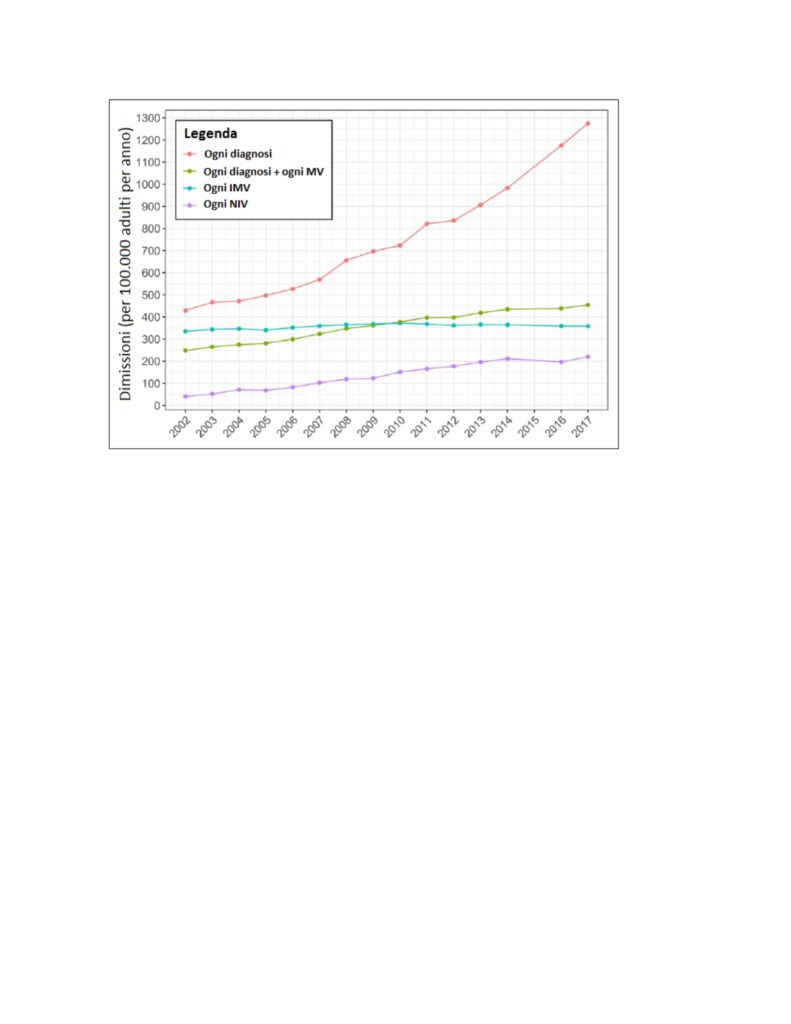
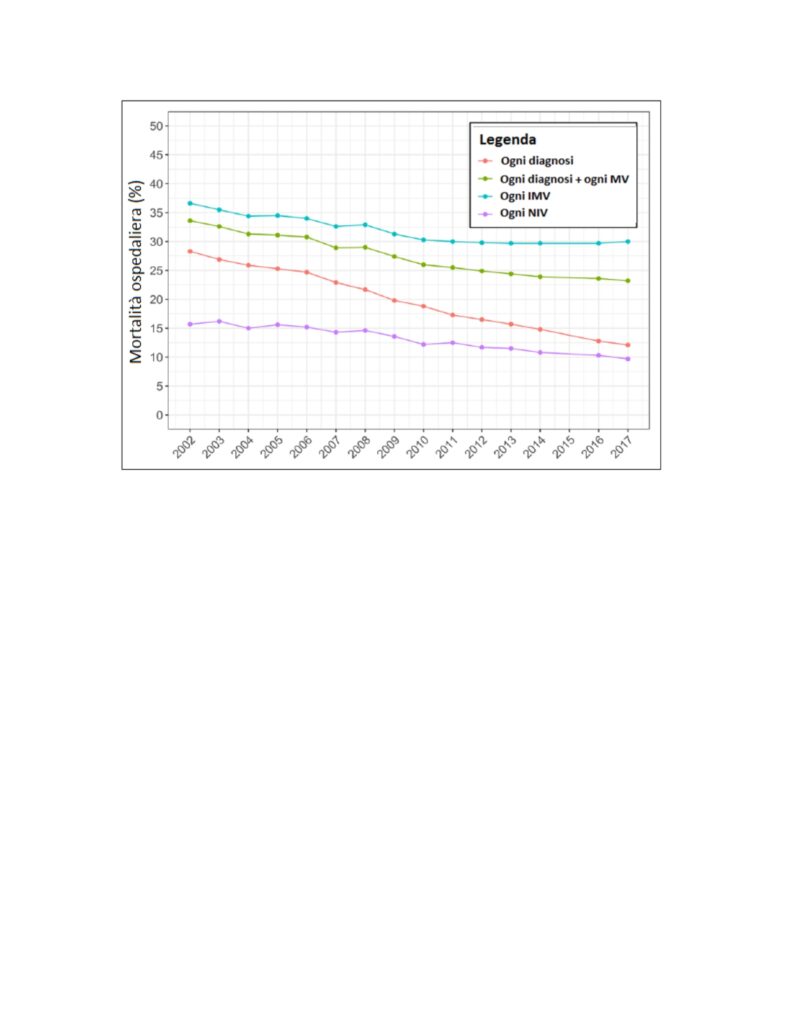
Figura 3 – Incidenza annuale per la diagnosi combinata di insufficienza respiratoria e di ventilazione meccanica (MV). Ogni diagnosi = una dimissione con un qualunque codice ICD-9 per insufficienza respiratoria; Ogni diagnosi + ogni MV = una dimissione con un qualunque codice per insufficienza respiratoria più un qualunque codice procedurale per MV invasiva (IMV) o non invasiva (NIV); Ogni IMV = una dimissione con un qualunque codice procedurale per intubazione endotracheale o IMV; Ogni NIV = una dimissione con un qualunque codice procedurale per NIV.
Figura 4 – Mortalità ospedaliera per la diagnosi combinata di insufficienza respiratoria e di ventilazione meccanica (MV). Ogni diagnosi = una dimissione con un qualunque codice ICD-9 per insufficienza respiratoria; Ogni diagnosi + ogni MV = una dimissione con un qualunque codice per insufficienza respiratoria più un qualunque codice procedurale per MV invasiva (IMV) o non invasiva (NIV); Ogni IMV = una dimissione con un qualunque codice procedurale per intubazione endotracheale o IMV; Ogni NIV = una dimissione con un qualunque codice procedurale per NIV.
Clinica
Il quadro clinico dell’insufficienza respiratoria acuta riconosce come sintomo principale la dispnea, la cui gravità è generalmente proporzionale alla gravità della compromissione funzionale respiratoria. L’ortopnea è più marcata ed evidente nei pazienti con associato scompenso cardiaco o nelle patologie neuromuscolari avanzate con compromissione dell’attività del muscolo diaframma. Oltre alla dispnea, il distress respiratorio si manifesta con tachipnea (frequenza respiratoria maggiore di 20 atti al minuto), utilizzo della muscolatura respiratoria accessoria e/o presenza di segni di affaticamento dei muscoli respiratori. Manifestazioni cliniche dell’affaticamento dei muscoli respiratori sono:
1) Respiro paradosso (paradossa retrazione inspiratoria dell’addome abbinata alla fisiologica espansione del torace) o alternante (periodi di respiro paradosso alternato a respiro normale)
2) Segno di Hoover (retrazione delle ultime coste verso l’interno)
3) Tirage intercostale e sovraclaveare
I segni clinici dell’ipossiemia sono la cianosi (si presenta quando vengono superati i 5 g/dl di emoglobina desaturata), e le possibili turbe neurologiche dello stato di vigilanza (con progressione fino al coma). L’ipossiemia cronica genera poliglobulia.
L’ipercapnia induce inizialmente l’attivazione dei centri respiratori (fino ad un livello di PaCO2 inferiore a 90 mmHg) e soprattutto un complesso quadro neurologico riconducibile ad una sofferenza metabolica dell’encefalo secondaria all’acidosi respiratoria. L’aumento della PaCO2 porta ad un aumento della pressione arteriosa, della frequenza cardiaca e della portata cardiaca per aumento dell’attività simpatica. Altri segni clinici sono la tachipnea e la sudorazione profusa fredda secondaria a vasodilatazione cutanea. I segni e sintomi principali, tuttavia, sono quelli legati all’encefalopatia che, se non viene instaurata una terapia eziologica adeguata, può evolvere attraverso turbe dell’attenzione, dell’orientamento, della percezione e della vigilanza fino allo stato di stupor e coma. Questi sintomi possono essere accompagnati da anomalie motorie come tremore, asterixis, mioclono multifocale.
Terapia
La terapia dell’insufficienza respiratoria si affianca al trattamento specifico della patologia che la ha causata. Gli obiettivi della terapia sono l’aumento dell’ossigenazione e la diminuzione dell’anidride carbonica: questo può essere ottenuto rispettivamente con l’ossigenoterapia e con la ventiloterapia, invasiva o non invasiva.
L’ossigeno è a tutti gli effetti un farmaco e viene somministrato per raggiungere nell’aria che il paziente inspira concentrazioni superiori a quelle dell’aria ambiente (che, ricordiamo, è del 21% circa) allo scopo di trattare o prevenire i sintomi e le manifestazioni dell’ipossiemia arteriosa. Questa terapia viene utilizzata sia in acuto che in cronico.
La ventilazione può essere invasiva o non invasiva e utilizzata in modalità continua o intermittente. È una forma di supporto meccanico che sostituisce parzialmente o totalmente il lavoro dei muscoli respiratori quando la pompa ventilatoria del paziente non è in grado di eseguirlo adeguatamente. Si pone, pertanto, l’obiettivo di ridurre il lavoro respiratorio migliorando al contempo gli scambi respiratori.
In questa sede tratteremo dell’ossigenoterapia a lungo termine (OTLT), ovvero somministrata per ≥15 ore/die in pazienti cronicamente ipossiemici. Tra questi distinguiamo pazienti con PaO2≤55 mmHg, quindi affetti da ipossiemia franca e pazienti con PaO2 tra 56 e 60 mmHg, affetti da ipossiemia borderline, detta anche moderata. I pazienti con ipossiemia latente sono pazienti che presentano ipossiemia sotto sforzo e/o notturna (AIPO 2018).
OSSIGENO TERAPIA A LUNGO TERMINE
La maggior parte degli studi in letteratura e delle linee guida riguardano i pazienti affetti da BPCO.
Gli studi in merito risalgono tutti a decenni fa in quanto, per motivi etici, successivamente non è stato possibile arruolare pazienti in ipossiemia continua che non utilizzassero l’ossigeno terapia.
Gli studi che possiamo considerare i capostipiti dell’OTLT nei pazienti BPCO risalgono al 1980 ed al 1981. Questi studi hanno dimostrato che l’OTLT è in grado di migliorare la sopravvivenza nel caso della BPCO con ipossiemia continua franca. Altri studi successivi hanno concluso che l’OTLT è in grado di migliorare la qualità della vita e la performance neuropsichica di ridurre i costi di ospedalizzazione riducendo i giorni di degenza.
Ormai da diversi anni, l’OTLT è stata ulteriormente estesa ai pazienti con ipossiemia moderata associata a policitemia, alla cardiopatia ischemica e alle aritmie, anche se i dati in letteratura sono risultati contrastanti.
Anche le indicazioni alla OTLT nelle patologie polmonari non BPCO con ipossiemia non hanno solide basi scientifiche e sono state ricavate dalle evidenze di questi studi eseguiti su pazienti con BPCO.
Indicazioni all’OTLT nella BPCO
La Regione Toscana, con le delibere n. 10107 del 14/11/88, n. 595 del 30/10/89 e n. 03274 del 22/3/91, ha attivato una procedura per la fornitura di ossigeno (liquido o con concentratori, vedi in seguito) ai pazienti affetti da insufficienza respiratoria cronica, avviando così un importante processo di regolamentazione nell’ambito della OTLT.
Secondo le linee guida della regione Toscana (aggiornamento 2015) l’OTLT deve essere somministrata almeno per 15 ore/die (meglio se 24 ore/die) nei pazienti BPCO che si trovino nelle seguenti condizioni:
- Indicazione assoluta nei pazienti con ipossiemia continua grave (PaO2<55 mmHg o SaO2 ≤88%, non modificabile con altre risorse terapeutiche);
- Indicazione relativa nei pazienti con ipossiemia borderline (PaO2 compresa tra 55 e 59 mmHg) qualora lo stato d’ipossiemia sia associato a una delle seguenti condizioni:
- policitemia stabile (ematocrito >55%)
- cuore polmonare cronico o ipertensione arteriosa polmonare
- edemi periferici da scompenso cardiaco destro.
Lo stato di ipossiemia è considerato stabile quando viene riscontrato:
- in almeno 4 determinazioni di emogasanalisi, effettuate in condizione di riposo da almeno 30-60 minuti, rilevate a intervalli regolari di 15 giorni per 2 mesi consecutivi;
- dopo almeno 3 mesi da un episodio di riacutizzazione.
Nel caso in cui le condizioni cliniche del paziente non siano stabili ma vi sia la necessità di ossigenoterapia, può essere iniziato un trattamento temporaneo con ossigeno, gassoso oppure liquido, in attesa di una valutazione successiva presso un centro specialistico in merito alla prosecuzione del trattamento in modo continuativo.
Al momento, anche le linee guida dell’Associazione Italiana Pneumologi Ospedalieri (AIPO) del 2018 confermano l’indicazione all’OTLT nei pazienti BPCO con ipossiemia continua grave e con ipossiemia borderline associata almeno ad un criterio aggiuntivo per ≥15 ore/die.
Ipossiemia latente sotto sforzo
Al momento gli studi [in particolare lo studio del LOTT Research Group]non hanno dimostrato l’efficacia dell’Ambulatory Oxygen Therapy (AOT: ossigenoterapia somministrata con device portatile durante l’esercizio fisico) nel migliorare la sopravvivenza e svariati altri parametri quali il tempo della prima ospedalizzazione per qualunque causa, l’incidenza di riacutizzazioni, l’aderenza all’ossigenoterapia, lo sviluppo di grave desaturazione da sforzo, i metri percorsi al test del cammino di 6 minuti (6MWT), la qualità di vita, la funzione polmonare, la frequenza di ospedalizzazioni totali, la frequenza di ospedalizzazioni legate e anche non legate alla BPCO, lo stato nutrizionale, il rischio di patologie cardiovascolari, la funzione neurocognitiva e l’ansia. Invece, in ambito riabilitativo, lo stesso studio riporta che l’AOT sembra migliorare la capacità all’esercizio fisico.
Quindi, secondo le linee guida dell’AIPO del 2018, l’AOT dovrebbe essere prescritta solo in pazienti che presentino una desaturazione da sforzo al 6MWT, ma non siano eleggibili per OTLT, in un ambito riabilitativo con verifica del miglioramento della capacità all’esercizio fisico. La prescrizione di AOT, inoltre, dovrebbe seguire criteri di rigida selezione e periodici controlli, essere riservata a coloro che escono di casa quasi ogni giorno e svolgono quotidianamente una discreta attività fisica. Quindi, l’eventuale prescrizione di AOT deve fare seguito a un 6MWT in cui si documenti una riduzione della SpO2 al di sotto del 90%: la prescrizione deve essere per le ore/die che verosimilmente il soggetto utilizza quotidianamente per l’attività fisica.
Per i pazienti con fibrosi polmonare e/o ipertensione polmonare primitiva che presentino desaturazione sotto sforzo con un delta di almeno 5 punti percentuali rispetto al valore a riposo, sarebbe raccomandato ricorrere alla somministrazione di ossigeno.
Ipossiemia latente notturna
L’indicazione all’ossigeno terapia notturna (NOT) in pazienti BPCO che non abbiano i criteri per l’OTLT è controversa, in quanto non ci sono evidenze che la NOT sia efficace e, in particolare, che migliori la sopravvivenza, l’emodinamica polmonare e la qualità del sonno. Tuttavia, è noto che i pazienti con BPCO avanzata che desaturino durante il sonno, abbiano una prognosi peggiore. Pertanto, le linee guida AIPO 2018, in attesa di nuovi studi, consigliano la prescrizione della NOT nei pazienti BPCO che per il 30% del tempo della registrazione della saturimetria notturna, rimangono sotto il 90% di saturazione. Questo preferibilmente in due registrazioni distinte.
Per quanto riguarda i pazienti affetti da Obstructive Sleep Apnea (OSA), Obesity Hypoventilation Syndrome (OHS), sindrome da overlap (OSA/BPCO), questi non devono essere trattati solo con NOT: il supplemento di ossigeno in corso di ventilazione non invasiva deve essere considerato nei soggetti in cui vi è indicazione a tale trattamento. Nei pazienti invece con scompenso cardiaco cronico e terapia medica massimale con documentata ipossiemia notturna, ma senza OSA o OHS, è prescrivibile l’ossigeno terapia notturna: il miglioramento deve essere verificato con saturimetria notturna. Nei pazienti con insufficienza respiratoria ipercapnica deve essere prescritta la NOT in associazione a NIV.
Nelle patologie neuromuscolari, la NOT non deve essere prescritta da sola se non sono presenti i criteri per l’OTLT. Può essere considerata nei soggetti ipercapnici in associazione al supporto ventilatorio.
Anche nelle pneumopatie interstiziali diffuse, la NOT non deve essere prescritta in pazienti che non abbiamo i criteri per OTLT. (AIPO 2018).
OTLT in altre patologie
Le indicazioni alla OTLT nelle patologie non-BPCO sono estrapolate dalle evidenze nei pazienti con BPCO ma senza conferma circa la sua efficacia. Pertanto, in assenza di prove definitive, le linee guida delle Regione Toscana consigliano la somministrazione di ossigeno laddove si dimostri una reale efficacia in termini di correzione dell’ipossiemia e di miglioramenti clinici o sintomatologici documentabili. Le linee guida AIPO 2018 aggiungono che, nelle patologie neuromuscolari e della gabbia toracica in cui la NIV rappresenti il trattamento di scelta, la OTLT deve essere utilizzata insieme alla ventilazione nei soggetti in cui l’ipossiemia non sia corretta dalla ventilazione. La dispnea refrattaria, in assenza di ipossiemia, non rappresenta un’indicazione alla prescrizione di OTLT.
Valutazione del paziente
Per confermare la presenza di insufficienza respiratoria e valutare il flusso di ossigeno necessario al paziente allo scopo di correggerla, è necessario:
- effettuare un’emogasanalisi arteriosa in aria ambiente col paziente a riposo da almeno 30 minuti;
- somministrare flussi progressivamente crescenti di O2 monitorando il valore di PaO2 o di saturazione non invasiva (SaO2), fino a ottenere il flusso considerato ottimale. Ogni flusso deve essere somministrato per almeno 20-30 minuti. Nel caso si rendano necessarie più misurazioni per raggiungere l’esatta dose, si può utilizzare la SaO2.
- effettuare l’emogasanalisi al termine dell’iter diagnostico (SEPTask Group 1989).
Viene considerato ottimale il flusso che:
- determina un innalzamento della PaO2 a >60 mmHg;
- induce un aumento dei valori di saturazione al di sopra del 92%;
- risulta ben tollerato da parte del paziente;
- non induce pericolosi incrementi della PaCO2 (in alcuni pazienti che necessitano di flussi elevati di O2, può verificarsi una ritenzione di CO2).
I pazienti non ipercapnici e senza altri disturbi respiratori del sonno (es. OSA) per un possibile peggioramento dell’ipossiemia dovuta alla fisiologica ipoventilazione indotta dal sonno, dovrebbero incrementare il flusso di 1 l/min durante il sonno (16) meglio se questo viene verificato con saturimetria notturna.
Follow-up del paziente
I pazienti immessi in OTLT potrebbero dover continuare tale terapia per tutta la vita. Al fine, quindi, di valutarne la reale necessità e l’adeguatezza del flusso somministrato, secondo le ultime linee guida della regione Toscana (agg. 2015) è opportuno effettuare una rivalutazione almeno annuale o in occasione di ogni cambiamento dello stato clinico del paziente. L’eventuale sospensione della OTLT deve essere successiva ad un’attenta valutazione clinica e funzionale del paziente.
Sorgenti e metodi di somministrazione di ossigeno
Le sorgenti utilizzate per somministrare ossigeno sono:
- Ossigeno gassoso
- Ossigeno liquido
- Concentratore di ossigeno
- Ossigeno terapia a alti flussi (HFNC)
L’ossigeno gassoso è indicato per erogare ossigeno occasionalmente a causa degli elevati costi e della durata limitata della bombola. È fornito ad alte pressioni (200 bar), racchiuso in bombole di acciaio (o in alluminio rinforzato con fibre di carbonio, al fine di ridurne il peso); può essere contenuto in cilindri di diverse dimensioni e capacità. Il cilindro è fornito di un riduttore di pressione con selettore di flusso, il quale permette di selezionare la quantità di litri al minuto da erogare. È inoltre consigliato l’utilizzo di un umidificatore riempito di acqua distillata (AIPO 2018 e 28).
L’ossigeno liquido viene ottenuto a partire dalla forma gassosa, raffreddandolo a temperature uguali o inferiori a –183°C alla pressione di 1 atmosfera. In questo modo circa 850 litri di ossigeno gassoso si trasformano in 1 litro di ossigeno liquido con conseguente vantaggio in termine di volume occupato. L’ossigeno liquido a contatto con l’ambiente esterno, cioè in fase di somministrazione, torna alla fase gassosa. I contenitori di ossigeno liquido (Fig. 5) sono quindi contenitori criogenici provvisti di una segnaletica, analogica nei modelli più datati (del tutto simile all’indicatore del livello di carburante di un’automobile) e a LED nei modelli più recenti, che indica il livello in percentuale di riempimento. Per mettere in funzione l’unità base, è necessario connettere l’umidificatore riempito di acqua distillata al punto di fuoriuscita dell’ossigeno, connettere l’interfaccia tramite il tubo di raccordo all’umidificatore e selezionare il flusso di ossigeno prescritto. Esiste un certo grado di dispersione anche quando il dispositivo non è utilizzato. (AIPO 2018) Dal reservoir principale, l’ossigeno liquido può essere trasferito in stroller (contenitori portatili e maneggevoli) che permettono al paziente di muoversi autonomamente. Questi hanno una capacità di 0,5 o 1,2 litri e un peso di circa 3 kg a pieno carico; consentono un flusso massimo di 6 o 15 l/min, a seconda del modello. Tale dispositivo permette una buona mobilità con una considerevole autonomia (ad esempio sono possibili circa 7 ore di autonomia a un flusso di 2 l/min con il dispositivo da 1,2 l).

Figura 5. Contenitore criogenico (“bombola”) di ossigeno liquido. In primo piano uno stroller.
Il concentratore di ossigeno è un dispositivo che funziona tramite l’energia elettrica di rete e/o da una batteria e che estrae l’ossigeno dall’aria dell’ambiente attraverso un sistema di filtri che rimuovono l’azoto, arrivando ad erogare una miscela ricca di ossigeno (dall’85% al 96%). Ne esistono modelli fissi e modelli trasportabili (tra cui i portatili) e può fornire un flusso continuo o intermittente (detto anche “pulsato”, quando l’erogazione dell’ossigeno avviene solo durante la fase inspiratoria). La performance dei concentratori dipende dalla tecnologia usata. Negli ultimi anni, i concentratori sono diventati più efficienti in termini di litri di ossigeno erogati e di leggerezza ma in generale, al momento, la performance dell’apparecchiatura diminuisce all’aumentare del flusso di ossigeno erogato.
Il concentratore fisso ha un peso di circa 10 kg e l’erogazione arriva fino a circa 4 l/min. Esistono però anche concentratori ad alto flusso in grado di erogare fino a 8 l/min. I concentratori trasportabili sono di dimensioni più piccole, di peso variabile a seconda del modello (da 4,5 agli 8,5 kg). Possono essere dotati di batteria e di un’ulteriore batteria di back-up; possono fornire flusso continuo (fino a 3 l/min) o intermittente (fino a 6 l/min). I concentratori “portatili” sono ancora più leggeri, pesando da 1 a 3,2 Kg; forniscono però solo un flusso intermittente. Quest’ultimo può non essere indicato per l’ossigeno terapia notturna in quanto, durante il sonno, il respiro diventa più superficiale e il trigger inspiratorio del paziente potrebbe non risultare sufficiente ad attivare l’erogazione dell’ossigeno. Alcuni concentratori possono essere collegati ai ventilatori e possono passare automaticamente da flusso intermittente a flusso continuo.
Rispetto all’ossigeno liquido, i concentratori hanno lo svantaggio di essere più rumorosi, erogano ossigeno a concentrazioni leggermente minori, consumano energia elettrica ma la loro gestione risulta in generale più economica, eliminando i costi di trasporto del frequente ricambio bombola.
L’ossigeno terapia ad alti flussi (HFNC) è una terapia di recente introduzione, largamente utilizzata in ambito ospedaliero, ma raramente a domicilio. La terapia ad alti flussi consiste nell’erogazione di una miscela calda e umidificata di aria e ossigeno a una temperatura compresa tra 31°C e 37°C, somministrata attraverso delle cannule nasali specifiche. Può essere fornito ossigeno fino a 15 l/min raggiungendo alte ed accuratamente quantificabili frazioni inspirate di ossigeno (FiO2). Tra i vantaggi ci sono quello di migliorare il comfort, la clearance mucociliare e ridurre il lavoro respiratorio fornendo una sia pur minima (circa 3-5 cmH2O) pressione positiva di fine espirazione (PEEP). Tra gli svantaggi, la necessità di richiedere elevati flussi di ossigeno.
Interfacce
Le interfacce sono:
- Cannule nasali (prima scelta)
- Maschera faciale
- Maschera di Venturi
- Maschere con reservoir
- Cateteri nasali
- Ossigeno terapia tramite tracheostomia/tracheotomia
Le cannule nasali (anche dette “occhialini” nasali, Fig. 6) costituiscono l’interfaccia più utilizzata, semplice e economica. Sono più accettati dai pazienti perché consentono di parlare e di mangiare. Sono a basso rischio di re-breathing ma consentono erogazioni di flussi non oltre i 6 l/min. La FiO2 somministrata al paziente con questo sistema non è molto accurata poiché dipende dalla frequenza respiratoria, dal volume corrente e dal rapporto fra tempo inspiratorio e tempo espiratorio (rapporto I/E); infatti, il flusso di 1 l/min consente un incremento della FiO2 di 3 punti (dal 21% dell’aria ambiente al 24%), mentre i successivi l/min permettono un incremento di 4 punti ciascuno (per esempio 5 l/min permettono di raggiungere una FiO2 del 40%).

Figura 6. Cannula nasale
Le maschere facciali rappresentano una buona alternativa alle cannule nasali. Vengono più frequentemente impiegate in ambiente ospedaliero e le prescrizioni domiciliari sono assai limitate. Possono essere utilizzate quando sono richiesti flussi più elevati. Le maschere sono utili per quei pazienti che abbiano una respirazione prevalentemente orale e per quelli che presentano una irritazione o una tendenza al sanguinamento della mucosa nasale. Sono tuttavia ingombranti, poco confortevoli e limitative; rispetto agli occhialini nasali ostacolano la comunicazione, impediscono l’alimentazione e aumentano lo spazio morto anatomico. Sono inoltre a rischio di re-breathing e non consentono un calcolo preciso della FiO2 somministrata al paziente.
La maschera di Venturi è utilizzata essenzialmente in ambito ospedaliero, questo tipo di maschera permette la somministrazione di ossigeno a concentrazioni fisse e prestabilite, anche a flussi elevati, consentendo di mantenere un rapporto costante tra ossigeno e aria ambiente sfruttando l’effetto Venturi. Infatti l’ossigeno sotto pressione passa attraverso un raccordo che ha uno stretto orifizio oltre il quale, aumentando di velocità, determina una pressione subatmosferica che risucchia l’aria ambiente all’interno del sistema, attraverso alcune finestre poste sul condotto. Variando la misura dell’orifizio ed il flusso dell’ossigeno, può essere ottenuta la FiO2 necessaria. Ogni maschera è dotata di raccordi colorati, ognuno dei quali corrispondente a una determinata FiO2, che vengono interposti tra maschera e circuito. I raccordi tipici inclusi nelle maschere prevedono l’erogazione di FiO2 del 24, 28, 31, 35, 40, 50 e 60%.
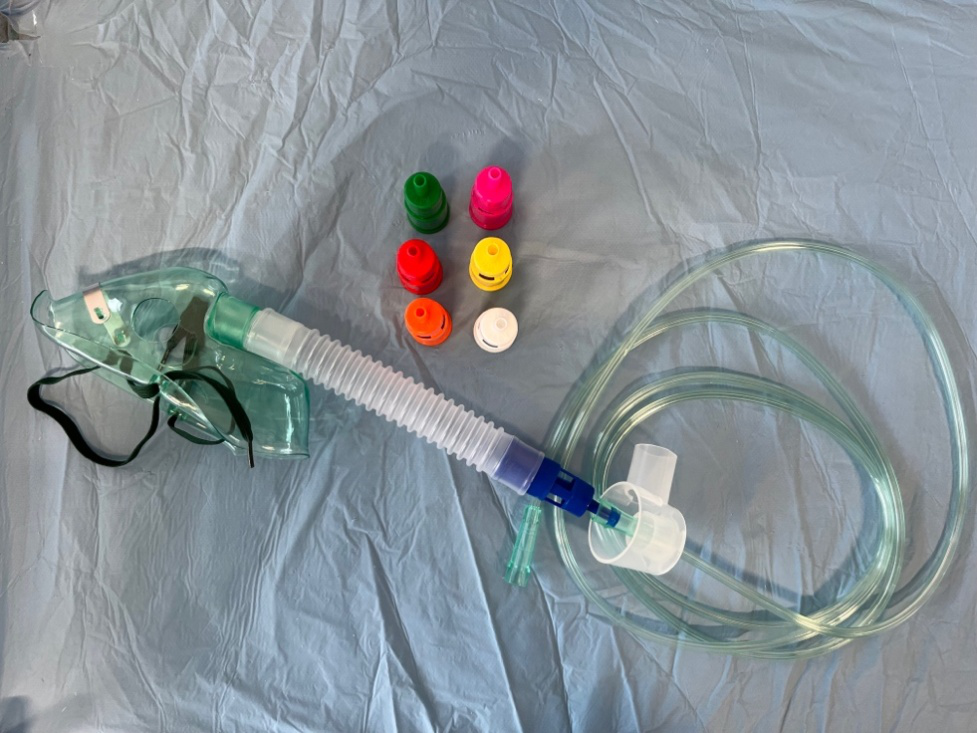
Figura 7. Maschera di Venturi con i suoi vari raccordi dosatori (vedi testo).
Anche i cateteri nasali sono essenzialmente utilizzati in ambiente ospedaliero e vengono posizionati in trachea attraverso le narici. Presentano alcuni vantaggi rispetto agli occhialini nasali, quali la stabilità, la minor dispersione di ossigeno e la diminuzione del lavoro respiratorio. Vi sono anche alcuni svantaggi: sono poco confortevoli e spesso causano decubito a livello delle mucose e della cute, dato che necessitano di essere fissati con del cerotto. Con l’impiego di questo tipo di interfaccia, si rende indispensabile umidificare l’ossigeno erogato, onde evitare la formazione di tappi di muco.
Esistono maschere corredate di reservoir attraverso le quali l’ossigeno raggiunge flussi di 8-10 l/min, in modo tale che il paziente possa inalare un’elevata concentrazione di ossigeno, raggiungendo una FiO2 del 90%, quando la maschera è ben aderente al volto. Essenzialmente utilizzate in ambito ospedaliero, possono risultare molto fastidiose per il paziente e difficili da tollerare. Inoltre, una più elevata concentrazione di ossigeno presenta un maggior rischio di ritenzione di CO2.
Nei pazienti sottoposti a tracheotomia/tracheostomia che necessitino solo di ossigeno terapia, è possibile utilizzare le maschere dotate di un elastico alla testa del paziente per mantenerle in posizione. Nei pazienti con cannula tracheotomica, è possibile utilizzare anche un naso artificiale con sistema di filtraggio e umidificazione da applicare alla cannula tramite un raccordo. È consigliato sempre l’utilizzo dell’umidificatore per evitare un’eccessiva secchezza delle mucose e delle secrezioni.

