Adamasco Cupisti,
Professore Ordinario SSD MED14 Nefrologia
Dipartimento di Medicina Clinica e Sperimentale, Università di Pisa
Direttore del Master “Nutrizione e dietetica in nefrologia”, Università di Pisa
Direttore della Scuola di Specializzazione in Nefrologia, Università di Pisa
Riassunto
La terapia nutrizionale è un elemento centrale che si integra perfettamente con quella farmacologica nella gestione del paziente con Malattia Renale Cronica. Le diete renali sono terapie efficaci per ritardare l’inizio della dialisi, per ridurre segni e sintomi del’insufficienza renale e per mantenere lo stato di nutrizione. Un’implementazione di successo richiede motivazione e una stretta interazione tra i pazienti e i membri di un team interdisciplinare che comprende medici, infermieri, dietisti e assistenti sociali, al fine di ottenere le massime possibilità di efficacia e sicurezza.
Parole chiave: dieta, proteine, Insufficienza renale, CKD, terapia nutrizionale
La malattia renale cronica rappresenta una patologia molto prevalente ed in crescita, in Italia ne è affetta il 7-8% della popolazione generale. Farmaci, una corretta alimentazione e stile di vita rappresentano fattori importanti per la prevenzione e il trattamento della insufficienza renale cronica.
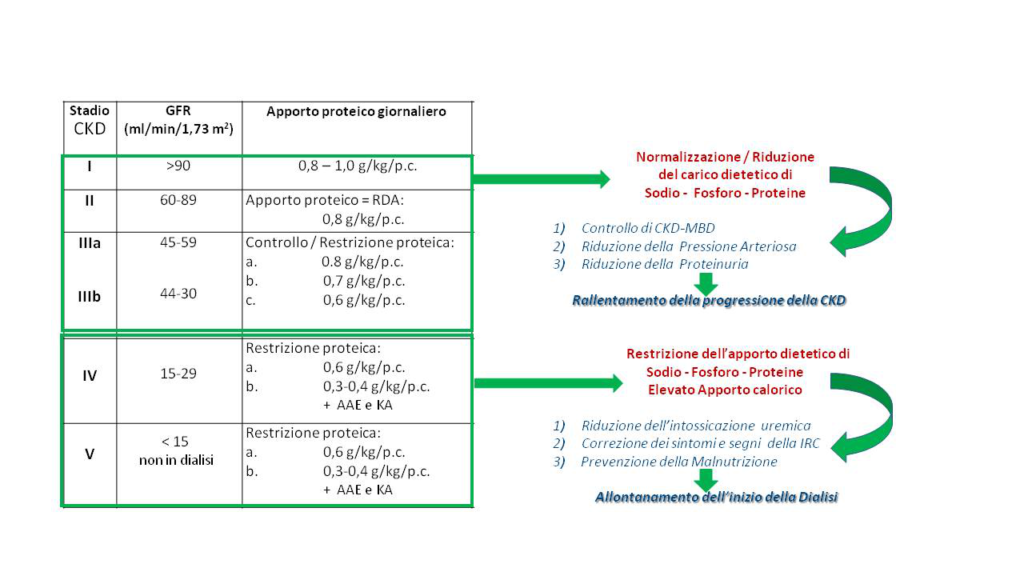
Fin dal XIX secolo era stato intuito che la sindrome uremica fosse causata dalla ritenzione di molecole e tossine derivanti dal catabolismo delle proteine dietetiche. Fu però solo dal 1964, con lo studio di Giovannetti e Maggiore, che la dieta ipoproteica ha assunto il ruolo di terapia dell’uremia cronica. Ancora oggi la terapia nutrizionale, sebbene con sfumature diverse, ha un ruolo centrale e in alcuni casi insostituibile nel trattamento conservativo della malattia renale cronica. Nelle fasi precoci di malattia può contribuire a rallentare la progressione della malattia, mentre nelle fasi più avanzate può prevenire e/o correggere segni e sintomi uremici e ritardare l’inizio della dialisi [Figura 1]. La terapia dietetica è essenziale anche nella prevenzione e nel trattamento della malnutrizione, degli squilibri idro-elettrolitici e acido-base, e delle alterazioni del metabolismo minerale.
Nel 2020 sono state pubblicate le nuove Linee Guida per la nutrizione nella malattia renale cronica. Per i pazienti non diabetici clinicamente stabili con malattia renale cronica in stadio 3-5 non dialisi, si raccomanda un apporto proteico di 0,55-0,60 g/kg/d o una dieta fortemente ipoproteica 0,28-0,43 g/kg/d integrata con aminoacidi essenziali e cheto analoghi. Lo stesso livello di raccomandazione non è stato raggiunto per i pazienti diabetici con nefropatia, per i quali si suggerisce una restrizione proteica meno spinta (0,6-0,8 g/kg/d).
L’apporto energetico, da sempre considerato di 30-35 Kcal/Kg/d, è stato rivisto abbassando il valore minimo a 25 Kcal/kg/d che meglio si adatta alla odierna popolazione dei pazienti nefropatici, sempre più anziana, comorbida e sedentaria.
Le diete ipoproteiche
Sebbene diversi tipi di regimi ipoproteici siano possibili nella pratica clinica, le seguenti tipologie sono quelle più frequentemente riportate nella letteratura medica, almeno nei paesi occidentali.
– La Dieta Ipoproteica standard apporta 0,6 g/kg/die di proteine, di cui almeno il 60% ad alto valore biologico, come, pesce e carne. Il fabbisogno energetico è garantito dai carboidrati (55-60 % dell’apporto energetico totale) e lipidi (30-35% dell’apporto energetico totale). Limitando gli alimenti ricchi di proteine e fosforo (come latticini e alimenti trasformati o con conservanti), la dieta è anche ipofosforica (600-700 mg/giorno), iposodica (5-6 grammi di sale da cucina). Nel contempo, aumentando l’assunzione di cibi di origine vegetale, interi, freschi o poco lavorati (frutta e verdura fresca, cereali e granaglie) questa dieta aggiunge i benefici derivanti dall’elevato apporto di fibre e alcali. Conciliare un basso apporto proteico con un apporto energetico da normale ad elevato è possibile grazie ai prodotti artificiali aproteici, che rappresentano la fonte energetica principale e ideale per il nefropatico. Questi prodotti includono pasta, tagliatelle, pane, biscotti, farina, minestre e dolci precotti: sono costituiti da carboidrati e pressoché privi di proteine e fosforo, e con basso contenuto di sale. Essi sono compresi nei nuovi LEA e dispensati dalla Regione come alimenti a fini dietetici speciali.
– La Dieta ipoproteica vegan con proteine complementari fornisce 0,7 g/kg di peso corporeo di proteine. È un’opzione quando non sono disponibili o accettati i prodotti aproteici. Per coprire il fabbisogno di aminoacidi essenziali si utilizzano combinazioni di cereali e legumi. Infatti, cereali e legumi sono rispettivamente poveri di lisina e metionina; tuttavia, poiché i cereali sono ricchi di metionina mentre la lisina è ben rappresentata nei legumi, le miscele di cereali e legumi sono complementari e adeguate dal punto di vista nutrizionale.
Nel caso di una LPD vegana con l’assunzione di proteine non selezionate, si ricorre alla integrazione di aminoacidi essenziali e/o chetoacidi (Ketosteril®), nella misura di 1 cp. ogni 10 Kg di peso corporeo. I chetoacidi sono aminoacidi senza il gruppo aminico, che viene rimpiazzato da un atomo di calcio: nell’uomo è possibile la loro transaminazione al corrispettivo amino acido. In questo modo si riduce ulteriormente la sintesi (e la ritenzione) di urea grazie al diverso destino del gruppo aminico.
– La dieta a bassissimo contenuto proteico apporta 0.3-0.4 g/kg/die di proteine, esclusivamente vegetali e non selezionate, e per questo viene obbligatoriamente supplementata con aminoacidi essenziali e chetoacidi ((Ketosteril®, 1 compressa ogni 5 Kg di peso corporeo). Questo regime dietetico richiede grande motivazione e impegno da parte dei pazienti e dei care-giver, ed è solitamente limitato a pazienti selezionati con CKD molto avanzata e con elevata aderenza alle restrizioni dietetiche. Viene generalmente implementato quando la dieta ipoproteica convenzionale o vegana non è sufficiente per mantenere un buon compenso metabolico e per procrastinare nel tempo, per scelta o necessità, l’inizio della dialisi.
Obiettivi terapeutici delle diete ipoproteiche
Le LPD funzionano perché riducono la produzione di prodotti di scarto derivati dalle proteine (animali in particolare) ed eliminati per via renale, con conseguente minore ritenzione di tossine uremiche, di fosforo, di sale e di acidi fissi. Rispetto alle proteine animali, e a parità di quantità, le proteine vegetali hanno effetti favorevoli sull’emodinamica glomerulare e sulla proteinuria, generano un minore carico acido e apportano un fosfato meno biodisponibile; inoltre l’elevato apporto di carboidrati complessi e fibre contribuisce a stabilire un favorevole equilibrio del microbiota intestinale, favorendo specie batteriche benefiche con predominanza del metabolismo saccarolitico. I principali obiettivi delle diete ipoproteiche sono:
a) allontanamento nel tempo dell’inizio della terapia sostitutiva renale (dialisi, trapianto)
b) prevenzione e il trattamento di segni e sintomi dell’insufficienza renale
c) prevenzione della malnutrizione
a questi si aggiunge anche un effetto additivo alla gestione farmacologica della proteinuria, ipertensione arteriosa, dislipidemia, metabolismo calcio-fosforo.
Il ritardo nell’inizio della terapia sostitutiva renale è un obiettivo primario delle LPD, che si può ottenere attraverso due modi. Attraverso la riduzione dell’iperfiltrazione del singolo nefrone, della proteinuria e del carico acido, si può rallentare il declino della funzione renale residua. Poi la restrizione proteica migliora l’assetto metabolico, riduce la sintomatologia uremica e mantiene lo stato nutrizionale permettendo così di posticipare la dialisi, a parità di funzione renale residua.
Questi benefici non sono necessariamente mediati dall’effetto della restrizione proteica, ma anche dalla riduzione del carico di sodio, fosforo e di acidi che derivano dalle proteine animali e da alimenti ultraprocessati. Invece, diete ricche di alimenti vegetali, forniscono un maggiore apporto di fibre, componenti bioattivi, vitamine, antiossidanti e una maggior carico di alcali. Ciò può avere implicazioni favorevoli nel controllo della pressione sanguigna e nella gestione dei disturbi metabolici come l’iperfosfatemia, l’iperpotassemia, l’acidosi metabolica e la dislipidemia. Inoltre, nei pazienti con insufficienza renale avanzata, un apporto di elevato fibre derivante da cibi vegetali è associato a una minore concentrazione di tossine uremiche derivanti dal microbiota intestinale, quali p-cresil solfato e indoxyl solfato.
Controindicazioni ed effetti indesiderati delle diete ipoproteiche
Come per le terapie farmacologiche, anche per le diete ipoproteiche esistono controindicazioni assolute o relative. Le malattie acute gravi o condizioni di stress si caratterizzano per ipercatabolismo proteico, aumentando così il fabbisogno proteico e rappresentano per questo una controindicazione assoluta. Alti livelli circolanti di citochine e molecole proinfiammatorie aumentano il catabolismo proteico per far fronte all’evento acuto. In questi contesti, un basso apporto proteico può attenuare la risposta allo stress e aumentare la perdita di massa magra. I disturbi del comportamento alimentare o una malnutrizione conclamata sono considerate controindicazioni assolute alla dieta ipoproteica. Infine, nelle cure di fine vita, l’avvio di una dieta ipoproteica è considerato inutile, a meno che non sia finalizzato al controllo dei sintomi.
Tra le controindicazioni relative possono rientrare la maggior parte delle cosiddette barriere (economiche, culturali, mancanza di supporto familiare o sociale, …) all’implementazione della dieta ipoproteica, disturbi psichiatrici, diabete scarsamente controllato, trattamento cronico con steroidi, malattie gastrointestinali croniche, inclusi disturbi della masticazione e breve aspettativa vita. Queste condizioni devono essere valutate e laddove possibile corrette prima di intraprendere una restrizione proteica.
Gli effetti indesiderati comprendono la perdita di massa grassa, a causa di un inadeguato apporto energetico; perdita di massa magra a causa di un inadeguato apporto proteico ed energetico; inoltre depressione, problemi relazionali, disagio psicologico, eccessiva restrizione proteica o mancata restrizione proteica .
La perdita di peso indesiderata è una delle preoccupazioni più importanti nei pazienti in trattamento con dieta ipoproteica. La riduzione del peso corporeo, quando non attribuita a disidratazione, è espressione di un apporto energetico inadeguato che è invariabilmente associato ad un aumento del fabbisogno di azoto; questo impedisce il mantenimento del bilancio azotato neutro o positivo che dovrebbe caratterizzare una dieta ipoproteica ben condotta. La perdita di massa magra può verificarsi sia quando l’apporto proteico e aminoacidico è inadeguato, sia quando l’apporto proteico è adeguato ma l’apporto energetico è insufficiente. È importante sottolineare che la perdita di massa magra può derivare anche da inattività fisica o stile di vita sedentario che devono sempre essere contrastati.
Comunque, i dati della letteratura confermano che una LPD, correttamente prescritta e applicata non comporta malnutrizione, anzi permette un migliore compenso metabolico e clinico della CKD.
Il punto centrale per ottenere gli effetti attesi e nello stesso tempo la sicurezza nutrizionale di una dieta ipoproteica è porre attenzione alle abitudini alimentari, impiegare un approccio graduale con stretto follow-up e personalizzare i piani dietetici. Tutto questo in particolare nei casi di diabete mellito, obesità e sindrome nefrosica, che richiedono particolari aggiustamenti dietologici.
Considerazioni Conclusive
La terapia nutrizionale è un elemento centrale che si integra perfettamente con quella farmacologica nella gestione del paziente con restrizione proteica. Le diete ipoproteiche sono terapie efficaci per ritardare l’inizio della dialisi, per ridurre segni e sintomi del’insufficienza renale e per mantenere lo stato di nutrizione. Come per tutte le terapia farmacologiche, le diete ipoproteiche hanno indicazioni e controindicazioni e possono comportare il rischio di effetti collaterali indesiderati che devono essere affrontati e risolti tempestivamente. Un’implementazione di successo richiede motivazione e una stretta interazione tra i pazienti e i membri di un team interdisciplinare che comprende medici, infermieri, dietisti e assistenti sociali, al fine di ottenere le massime possibilità di efficacia e sicurezza.
Figura 1: Funzione renale, apporto proteico e obiettivi clinici.
L’autore dichiara di aver ricevuto i seguenti finanziamenti o di avere i seguenti contratti in corso, personali o istituzionali, con soggetti pubblici o privati i cui prodotti o servizi sono citati nella pubblicazione: Dr Shaer, Fresenius Kabi.

